Akibatnya senyawa ion memiliki titik didih dan titik leleh. Sifat fisik senyawa ion adalah sebagai berikut.

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen
Berikut ini ringkasan singkat perbedaan antara ikatan ion dan kovalen sifat-sifatnya dan cara mengenalinya.

. NaCl CaF2 AlCl3 dan lain-lain. Akibatnya titik lebur dan titik didih senyawa ion lebih tinggi dibandingkan dengan senyawa kovalen. O2 CO2 HCl dan sebagainya.
Senyawa kovalen berwujud lunak dan tidak mudah rapuh. Begitu juga dengan senyawa ion dan kovalen. Perbedaan ion dan.
Kemudahan menguap dari suatu zat berhubungan dengan gaya tarik antar molekul. Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih. Ini seperti kerja tim.
Titik leleh yang tinggi dan titik didih jika terjadi dalam ikatan ionik. Senyawa kovalen memiliki titik didih dan titik leleh yang rendah. Berikut ini akan dibahas beberapa perbedaan sifat fisika senyawa ion dan senyawa kovalen seperti kemudahan menguap.
Senyawa yang mengandung ikatan kovalen polar larut dalam air sedangkan senyawa kovalen nonpolar biasanya larut dalam pelarut organik. Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih. Namun untuk membuat senyawa atom harus terikat bersama.
Juga senyawa kovalen dapat larut dalam air tetapi tidak berdisosiasi menjadi ion. Alasan untuk fakta ini adalah bahwa senyawa ionik memerlukan sejumlah besar energi untuk memutuskan ikatan ionik mereka dan memisahkan gaya tarik muatan positif dan negatif. Ikatan ionik pada dasarnya menyumbangkan elektron ke atom lain yang berpartisipasi dalam ikatan sementara elektron dalam ikatan kovalen dibagi secara merata di.
Jika ditinjau dari sifat fisik kedua senyawa ini perbedaannya adalah sebagai berikut. Ikatan kovalen adalah non-konduktor sedangkan ikatan ion adalah konduktor. Perbedaan senyawa Ion dan senyawa Kovalen Pada Kesempatan kali ini file education akan membahas artikel Perbeadaan Sifat senyawa ion dan senyawa kovalen.
Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Dua jenis utama ikatan kimia adalah ikatan ionik dan kovalen. Namun konduktivitas larutan yang mengandung ikatan kovalen tidak sebaik larutan yang mengandung ikatan ion.
Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Pada ikatan ion terjadi gaya elektrostatik gaya Coulomb sehingga pada senyawa ion diperlukan energi lebih besar untuk mengalahkan gaya tersebut. Otakers selain ditentukan oleh titik didihnya setiap senyawa juga memiliki beberapa perbedaan sifat fisik yang lain lho apa saja itu.
Ikatan ion terjadi antara atom-atom yang sangat berbeda dalam keelektronegatifan. Senyawa kovalen tidak dapat menghantarkan listrik. Titik didih dan titik leleh tinggi.
Senyawa ion merupakan senyawa yang terbentuk dari ikatan antara unsur logam dan nonlogam. Senyawa ion adalah senyawa yang terbentuk dari dua atom yang saling berikatan karena adanya perpindahan elektron dari satu atom ke atom lain. Ringkasan perbedaan Ikatan ion dan kovalen.
Namun tidak semua ikatan kimia diciptakan sama seperti yang akan Anda lihat dalam kasus ikatan ionik vs. Senyawa ion pada suhu kamar sebagian besar berbentuk padat keras tetapi mudah patah dengan titik didih dan titik leleh relatif tinggi sekitar 350C-1000C. Hal ini membuat titik didih dan titik leleh relatif lebih rendah daripada ikatan ionik.
HF asam florida. Jelajahi perbedaan antara ikatan ionik dan kovalen dengan melihat setiap ikatan yang berbeda dan bagaimana ikatan itu terbentuk. Pelarutan Senyawa Ionik dan Kovalen.
Pada umumnya senyawa ion larut dalam pelarut polar seperti air dan ammonia karena sebagian molekul pelarut menghadapkan kutub negatifnya ke ion positif dan sebagian lagi menghadapkan kutub positifnya ke ion negatif. Home KIMIA Kimia Kelas 1 Perbedaan senyawa Ion dan senyawa Kovalen. ASifat Fisik Senyawa Ion.
Sifat senyawa ion maupun sifat senyawa kovalen dapat kita jabarkan sebagai berikut. Contohnya larutan garam NaCl dilarutkan oleh air. Banyak perbedaan dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopisnya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih.
Senyawa ionik adalah senyawa yang terbentuk karena adanya ikatan ion sedangkan senyawa kovalen terbentuk karena adanya ikatan kovalen. Berikut ini akan dibahas beberapa perbedaan sifat fisik senyawa ion dan senyawa kovalen seperti kemudahan menguap volatile daya hantar listrik. Mereka juga memiliki sifatnya sendiri sehingga bisa menjadi pembeda dengan senyawa yang lain.
Biasanya senyawa kovalen mampu mendidih di bawah 200 C sedangkan senyawa ion biasanya bisa mendidih di atas suhu 900 C. Diantara senyawa ionik dan senyawa kovalen tidak terdapat garis pemisah yang jelas. Pada kasus tersebut cuka mudah menguap dibandingkan garam dapur.
Titik Didih Senyawa ion memiliki titik didih yang tinggi sedangkan senyawa kovalen memiliki titik didih yang rendah. Senyawa ion dan senyawa kovalen sama-sama memiliki ikatan yang kuat. Jadi perbedaan sifat senyawa ionik dan kovalen dapat dilihat dari wujudnya titik didih dan titik leleh kelarutan dan.
Perbedaan Kunci - Senyawa Ionic vs Kovalen. Nah yang namanya interaksi berarti kita akan nyerempet-nyerempet ke jenis ikatan kimia seperti ikatan ionik kovalen polar dan nonpolar. Ikatan kovalen membutuhkan.
Senyawa yang terikat secara kovalen biasanya berupa gas atau cairan dengan titik leleh dan titik didih yang rendah. Namun kekuatan ikatan kovalen lebih lemah dibandingkan ikatan ion. Ikatan kovalen terjadi antara atom-atom yang sedikit berbeda dalam keelektronegatifan.
Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Berikut ini ringkasan singkat perbedaan antara ikatan ion dan kovalen sifat-sifatnya dan cara mengenalinya. Senyawa ionik memiliki titik leleh dan titik didih yang tinggi sedangkan senyawa kovalen memiliki titik leleh dan titik didih yang relatif rendah.
Contoh ikatan kovalen adalah gas metana atau CH4 di mana atom karbon berbagi elektron dengan 4 atom hidrogen dan amonia atau gas NH3 di mana atom nitrogen berbagi elektron dengan 3 atom hidrogen. Titik didih cuka 119 C dan garam dapur 1517 C. 9 rows misalnya natrium dan klorida membentuk ikatan.
Titik didih cuka 119C dan garam dapur 1517C. Mudah larut dalam pelarut polar. Kekuatan ikatan antar partikel menyebabkan perbedaan titik leleh senyawa ion dan kovalen.
Perbedaan selanjutnya yang akan sobat pelajari di kelas X ini adalah daya. Ngomong-ngomong tentang larutan terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. Oleh karena itu pola ikatan mereka dapat.
Praktikum Kimia Membandingkan Sifat Fisik Kemudahan Menguap Senyawa Ion dan Senyawa Kovalen 3. Oleh karena itu pola ikatan dapat dianggap sebagai kunci perbedaan antara senyawa ionik dan kovalen. Bentuk senyawa ion berupa zat padat pada suhu kamar.
Senyawa kovalen merupakan senyawa yang terbentuk dari ikatan antara unsur-unsur nonlogam. Sedangkan senyawa kovalen pada suhu kamar dapat berupa padat cair atau gas dengan titik.

Top 10 Jelaskan Perbedaan Daya Hantar Listrik Dari Senyawa Ion Dan Senyawa Kovalen Yang Berupa Padatan 2022
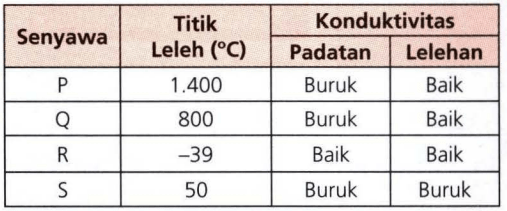
Perhatikan Sifat Sifat Senyawa Dalam Tabel Berikut

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id

Perbedaan Senyawa Ion Dan Kovalen

Perbedaan Senyawa Ion Senyawa Kovalen Dan Lo Utakatikotak Com
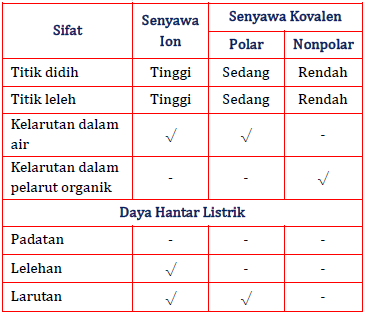
Diketahui Data Fisik Dua Buah Senyawa Sebagai Beri
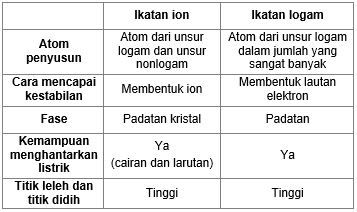
Lakukan Analisis Apakah Perbedaan Dan Persamaan Da

Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Sebutkan 5 Contoh Perbedaan Antara Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Perbedaan Ikatan Ionik Ikatan Kovalen Dan Ikatan Logam

Tuliskan Dalam Bentuk Tabel Minimal 8 Senyawa Ion Beserta Titik Leleh Dan Titik Didih Brainly Co Id

Sebutkan 8 Perbedaan Senyawa Polar Dan Nonpolar Konsep Pentingnya Usaha Tiga Dua Satu

Buat Yang Kelas 10 Yuk Mengenal Ikatan Ikatan Kimia Dalam Atom
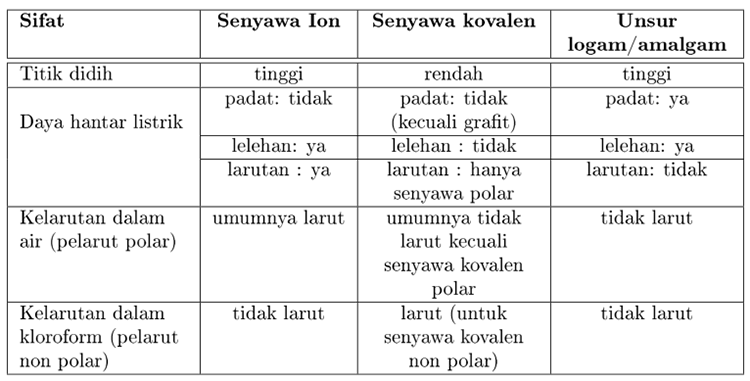
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset

Doc Perbandingan Sifat Senyawa Ion Dan Senyawa Kovalen Insani Fitri Academia Edu

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube
